Monoklonale Gammopathie unklarer Signifikanz (MGUS)

Eine Erkrankung oder ein Risikofaktor für die Osteoporose?
Die Osteoporose wird definiert als eine Frakturrisikoerkrankung. Das signifikant erhöhte Frakturrisiko weist eine Vielzahl von Faktoren auf, die zu einem fortschreitenden Abbau des Knochens und konsekutiv zu einer Abnahme der Knochenfestigkeit führen können. Durch die erfolgreiche Forschung zu den molekularbiologischen sowie biochemischen Grundlagen und klinischen Ursachen der Osteoporose sind in den letzten 3 Jahrzehnten weitere Faktoren zusammengetragen worden, die das Risiko für eine Fraktur erhöhen können.
Osteologie als interdisziplinäre Schnittstelle
Unter diesen Umständen wird das Fachgebiet der Osteologie immer umfangreicher, aber auch spannender und abwechslungsreicher. Die Aufgabe des Osteologen ist es, sich mit diesen Schnittstellen der medizinischen Disziplinen auseinanderzusetzen und den Stellenwert zu definieren.
In diesem Beitrag soll ein nicht seltener Risikofaktor beschrieben werden: Die monoklonale Gammopathie unklarer Signifikanz (MGUS).
MGUS als Risikofaktor für die Entwicklung der Osteoporose
Die MGUS ist vorwiegend eine Labordiagnose und im engeren Sinne keine eigenständige Krankheit. Im Blut sind vermehrt bestimmte Eiweiße nachweisbar (monoklonale Immunglobuline, auch M-Protein oder Paraprotein genannt). Diese Veränderungen im Blut spiegeln sich nicht zwangsläufig sofort in klinischen Symptomen wider. Allerdings haben MGUS-Patienten ein lebenslanges Risiko zur Entwicklung behandlungs-bedürftiger Erkrankungen (hämatologische oder M-Protein-assoziierte Erkrankungen, Osteoporose, erhöhte Infektanfälligkeit und Thromboseneigung). Der Befund wird häufig zufällig oder beim gezielten Screening von Patienten mit Fragilitäts-Frakturen unklarer Genese erhoben. Beim Nachweis des M-Proteins muss in jedem Fall geklärt werden, ob eine behandlungsbedürftige Krankheit (z.B. ein Multiples Myelom, eine AL Amyloidose, etc.) vorliegt oder ob es sich um eine kontrollbedürftige MGUS handelt.
Die MGUS kann sich zu diversen malignen lymphoproliferativen Erkrankungen wie z.B. dem Mul-tiplen Myelom, dem Morbus Waldenström oder einer AL Amyloidose entwickeln.
Da die MGUS (s.u.) einen Risiko-faktor für Frakturen darstellt, ist der Nachweis nicht als harmlose Blutveränderung einzuordnen, sondern von klinischer Relevanz. Eine spezifische Behandlung ist bei der MGUS zunächst nicht vorgesehen, jedoch stellt das konsekutive Frakturrisiko eine Therapieindikation dar.
MGUS in den DVO-Leitlinien
„Eine monoklonale Gammopathie unklarer Signifikanz (MGUS) ist mit einem 1,7-fach erhöhten Risiko für allgemeine Frakturen (inklusive der Hüftfrakturen) (1) und mit einem bis zu 6,3-fach erhöhten Risiko für vertebrale Frakturen verbunden (2,3,4,5). Ebenso ist die Prävalenz von MGUS mit 15% bei Osteoporosepatienten mit akuten vertebralen Frakturen gegenüber zur Normalbevölkerung signifikant erhöht (6). Zur Therapie der Osteoporose bei MGUS ist eine antiresorptive Therapie in Erwägung zu ziehen (7,8). Frakturdaten fehlen.
Für Einzelheiten zur Diagnostik und Therapie auch in Bezug auf die Osteoporose wird auf die besonderen Empfehlungen der hämatologisch/onkologischen Fachgesellschaften verwiesen. Für die Diagnostik Monoklonaler Gammopathien wird die Durchführung einer Kombination aus Serumproteinelektrophorese, Bestimmung der Freien Leichtketten und Immunfixation im Serum empfohlen.“[zitiert nach] DVO-LL-Text 2017 (18), 5.2. Monoklonale Gammopathie unklarer Signifikanz
Definitionen
Eine MGUS ist häufig und findet sich bei 1-3% aller Erwachsenen im Alter über 50 Jahre. Die Häufigkeit steigt mit dem Alter. Männer sind etwas häufiger betroffen als Frauen.
Eine MGUS kann die Vorstufe einer bösartigen Erkrankung von Zellen des Immunsystems sein, z.B. eines Multiplen Myeloms (MM). Das Risiko für den Übergang einer MGUS in ein MM liegt durchschnittlich bei 1-1,5% pro Jahr. Auf Basis der Laborbefunde kann das individuelle Risiko des Patienten bestimmt werden.
Nach gesicherter Diagnose werden Kontrollen nach 3 und 6 Monaten empfohlen. Bei niedrigem Progres-sionsrisiko und stabilen Befunden sind keine weiteren regelmäßigen Kontrollen erforderlich. Patienten mit einem oder mehreren Risiko-faktoren (abnormaler Freier-Leichtketten-Quotient, M-Protein ≥ 15g/l, kein IgG-Typ) und Personen mit steigenden Immunglobulin-Werten sollten regelmäßig vom Facharzt untersucht werden.
Epidemiologie
In einer Studie Ende der 90er Jahre untersuchten Kyle und Kollegen die Serumproben von > 21.000 Männern und Frauen aus der Region Olmsted County, Minnesota. Die allgemeine Prävalenz der MGUS betrug 3,2% in der Bevölkerung ≥ 50 Jahre. Dabei war die altersangepasste Prävalenz bei Männern mit 4,0% signifikant (p<0,001) höher als bei Frauen mit 2,7%. Die Prävalenz der MGUS betrug bei Personen über 70 Jahren 5,3% und bei über 85-jährigen 7,5%.
Risiko der Progression zu einer hämatologischen Erkrankung
Für MGUS mit intakten Immunglobulinen beträgt das Risiko für den Übergang in ein Multiples Myelom oder ein anderes malignes Lymphom ca. 1% für IgG- und IgA-MGUS und 1,5% für IgM-MGUS pro Jahr. Für MGUS mit ausschließlicher Leichtkettenproduktion beträgt das Risiko zum Übergang in ein Leichtkettenmyelom 0,3% pro Jahr. Das Risiko zur Entwicklung einer Niereninsuffizienz ist bei der Beteiligung freier Leichtketten durch die Affinität zu Organablagerungen erhöht.
Epidemiologische Untersuchungen belegen große individuelle Schwankungen in der Progressionswahrscheinlichkeit von MGUS zum Multiplen Myelom. In einer über 34 Jahre dauernden Langzeitbeobachtung zur Progression der MGUS von Kyle et al. wurde bei 11% der Patienten die Entwicklung eines Multiplen Myeloms diagnostiziert, was im Vergleich zu einer Kontrollpopulation einer 6,5-fach höheren Inzidenz entsprach. Das kumulative Progressionsrisiko betrug in den ersten 10 Jahren 10%, nach 20 Jahren 18%, nach 30 Jahren 28%, nach 35 Jahren 36% und nach mehr als 40 Jahren 36%.
Bei Patienten mit einer IgM-MGUS verbunden mit zwei unterschiedlichen Risiko-Faktoren (1. abnormaler Freier-Leichtketten-Quotient im Serum, 2. eine Serumkonzentration des M-Proteins ≥15 g/l), betrug das Progressionsrisiko nach 20 Jahren 55%. Im Vergleich betrug das Progressionsrisiko bei einer Population mit nur einem Risiko-Faktor nur 41% und bei der Population ohne Risikofaktoren 19%. Bei nicht-IgM-MGUS Patienten war das Progressionsrisiko signifikant geringer (30%, 20% bzw. 7%).
In dieser populationsbasierten Studie über den Langzeitverlauf von 34 Jahren wurde zudem gezeigt, dass betroffene Patienten eine geringere Lebenserwartung haben als Personen in einer alters- und geschlechtsangepassten Kontrollgruppe ohne MGUS. Zusätzlich zu dem Risiko einer malignen Progression könnte auch eine ernsthafte Erkrankung, die zur MGUS-Diagnose geführt hat, die Lebenserwartung beeinflusst haben.
Die Ergebnisse der Studie lassen den Schluss zu, dass das Risiko einer Progression zu einem Myelom oder einer entsprechenden Erkrankung deutlich geringer sein kann als der Tod durch eine andere Ursache. Derzeit gibt es nur wenige Daten, die belegen, dass ein Screening oder Monitoring der MGUS das Schicksal des Patienten erheblich verbessern kann. Eine Studie zur Klärung dieser Fragestellung wurde aktuell in Island initiiert (www.blodskimun.is).
Knochenaffektionen
Sowohl bei der MGUS als auch beim MM sind die Knochenumsatzmarker bei exzessiver Zytokinexpression erhöht, was darauf hinweisen kann, dass zunächst ein vermehrter Knochenabbau stattfindet; gefolgt von einem erhöhten Frakturrisiko. Knochenmarker wie RANKL und Osteoprotegerin (OPG) spielen offensichtlich eine wichtige Rolle für den Knochenabbau bei MGUS und für die Entwicklung von Osteolysen beim MM. DKK1 ist ebenfalls erhöht und ein Hinweis für eine Inhibition des Wnt-Signalwegs mit Verminderung des Knochenaufbaus.
Das allgemeine Frakturrisiko ist bei der MGUS um das 1,7-fache erhöht, das vertebrale Frakturrisiko um das 6,3-fache. Es zeigt sich keine Zunahme der peripheren Frakturen.
Piot et al. verglichen MGUS-Patienten mit unterschiedlichen Leichtketten-Konzentrationen und konnten feststellen, dass das vertebrale Frakturrisiko bei erhöhten Lambda-Leichtketten-Werten um das 4,32-fache erhöht ist – unabhängig von der Knochenmasse (BMD).
In einer Untersuchung von Ng et al. an 50 MGUS-Patienten im Vergleich zu einer gesunden Kontrollgruppe wurde mittels micro-CT-Untersuchungen festgestellt, dass die trabekuläre (p<0,01) und kortikale Dicke (p<0,05) bei den MGUS-Patienten signifikant geringer waren, ebenso wie die kortikale volumetrische Dichte (p<0,001). Die endokortikale (p<0,01) und die gesamte Querschnittsfläche waren bei den MGUS-Patienten signifikant größer als Hinweis für einen endokortikalen Knochenverlust.
Mit der Knochenmassemessung (DXA) können derartige Veränderungen nicht festgestellt werden. Die DXA-Messung liefert somit keinen Beitrag zur tatsächlichen Zunahme des Frakturrisikos. Dies konnte in eigenen Untersuchungen mit der micro-CT bestätigt werden (Felsenberg, Armbrecht, Ritter, prepared for publication 2018).
Die CRAB-Kriterien
C = Calcium im Sinne einer Hyperkalzämie
Renal = eingeschränkte Nieren- funktion
A = Anämie
B = Bone, wie Osteoporose sowie typische Osteolysen
Diagnostik (Klinik/Labor)
Eine MGUS wird diagnostiziert bei Vorliegen folgender Parameter:
1.Serum-Konzentration mono- klonaler Immunglobuline von < 30g/l
2.Weniger als 10% Plasmazellen im Knochenmark
3.Fehlen klinischer Symptome, die auf ein MM oder eine andere lymphoproliferative Erkrankung hinweisen könnte (s. CRAB- Kriterien)
Neben einer ausführlichen Anamnese und der körperlichen Untersuchung sollte die osteologische Basis-Labor-Diagnostik folgende Parameter umfassen.
Erweitertes Labor für den Osteologen:
- Blutbild & Differential-Blutbild
- Elektrolyte (Na, K, Ca, P)
- Nierenfunktion (Kreatinin, GFR, Harnstoff)
- Gesamteiweiß und Albumin im Serum, Immunglobuline (IgG, IgA, IgM) quantitativ, Freie Leichtketten Kappa und Lambda im Serum quantitativ, inkl. Berechnung des Quotienten. Entsprechende Urinuntersuchung auf Eiweiß.
- TSH, CRP, AP, Gamma-GT
- Einzelfallentscheidungen für: Testosteron b. Mann, 25-OH Vit. D, Knochenmarker (CTX, P1NP)
Das Verhältnis von Kappa(κ)- zu Lambda(λ)-Leichtketten (κ/λ-Quotient) ist ein sensitiver Indikator für die Klonalität (Referenz-bereich des κ/λ-Quotienten 0,26- 1,65). Eine pathologische Veränderung des Quotienten (Erhöhung oder Erniedrigung) ist ein wichtiger Hinweis auf eine selektive, meist monoklonale Überproduktion eines Leichtkettentyps und damit ein Hinweis auf eine monoklonale Gammopathie.
Ein pathologischer Quotient ist ein unabhängiger Risikofaktor für die Progression zu einer malignen Erkrankung. Erhöhte Konzentrationen beider freier Leichtketten bei normalem κ/λ-Quotienten sprechen für eine eher polyklonale Überproduktion z.B. bei entzündlichem Geschehen oder einer verminderten Filtration bei Nierenerkrankungen.
Bei Niereninsuffizienz kommt es aufgrund einer verminderten Nierenfiltrationsrate zu einer leichten Verschiebung des κ/λ-Quotienten. Daher sollte für diese Patienten ein modifizierter Referenzbereich von 0,37-3,1 verwendet werden.
Zur Überprüfung der Knochenstoffwechselaktivität sind Serum-Parameter wie CTX, P1NP, BAP, Osteocalcin, 25-OH Vit D3, PTH sehr hilfreich und optional zu bestimmen. Bei der Verlaufskontrolle reicht das Basislabor (s.o.) je nach Gesamtkonstellation im Abstand von 3-6 Monaten aus. Knochendichtemessungen sind alle 2-3 Jahre erforderlich.
Therapeutische Ansätze
Eine hämatologisch-onkologische Therapie ist zurzeit bei MGUS nicht vorgesehen. Nach unserer heutigen Auffassung muss die MGUS als Risikofaktor für die Entwicklung einer Osteoporose (Frakturrisiko) spezifisch behandelt werden. Die sekundären Risiken – wie die Knochenmasse-Verluste und das Frakturrisiko – sind zwingend behandlungsbedürftig.
Eine antiresorptive Therapie mit Bisphosphonaten und Denosumab ist indiziert; als Begleittherapie ist Vitamin D (1.000 IE) und Kalzium (1.000 mg/Tag, vorwiegend durch kalziumreiche Kost oder Mineralwässer) zu empfehlen.
Eine osteoanabole Therapie ist kontraindiziert (kein Teriparatid). Intensives muskuläres Training (Myokinexpression als antientzündliche Therapiebegleitung und Knochenstimulation) zur Senkung des Sturzrisikos wird empfohlen.
Fazit
- Durch den Osteologen sollte eine MGUS-Diagnostik und auch eine erste Risikoabschätzung erfolgen.
- Interdisziplinäre Zusammen-arbeit mit Onkologen/Hämato-logen ist eine Conditio sine qua non.
- MGUS selbst muss nicht behandelt werden, aber das konsekutive Frakturrisiko stellt eine Therapieindikation dar (s. Abschnitt “Therapeutische Ansätze”).
- Ein erhöhtes Frakturrisiko ist nicht allein überDXA-Messung einzuschätzen, da vorwiegend trabekuläre und kortikaleStrukturstörungen auftreten.
- Eine antiresorptive Therapie (+D3 & Ca) ist für betroffene Patienten die einzige mögliche Option.
- Knochenmarker (P1NP, CTX, AP, DKK1) sollten kontrolliert werden.
- Im Rahmen einer hämato- logischen Abklärung sollte die Bestimmung der freien Leichtketten im Serum zusammen mit elektrophoretischen Me-thoden möglichst frühzeitig erfolgen.
Literatur beim Verfasser
Quelle: FORUM SANITAS 2_2018
Prof. Dr. med. Dieter Felsenberg
Charité – Campus Benjamin Franklin
Hochschulambulanz Osteologie/Orthopädie/Muskel
Zentrum für Muskel- und Knochenforschung
Klinik für Unfall- und Wiederherstellungschirurgie
Freie Universität & Humboldt-Universität Berlin
Hindenburgdamm 30
12203 Berlin
www.zmk.charite.de

Abb. 1: Prävalenz der MGUS in einer populationsbezogenen Querschnittsstudie aus der Region Olmsted County, Minnesota. Signifikante Zunahme der Prävalenz mit dem Alter. Männer sind häufiger betroffen als Frauen.
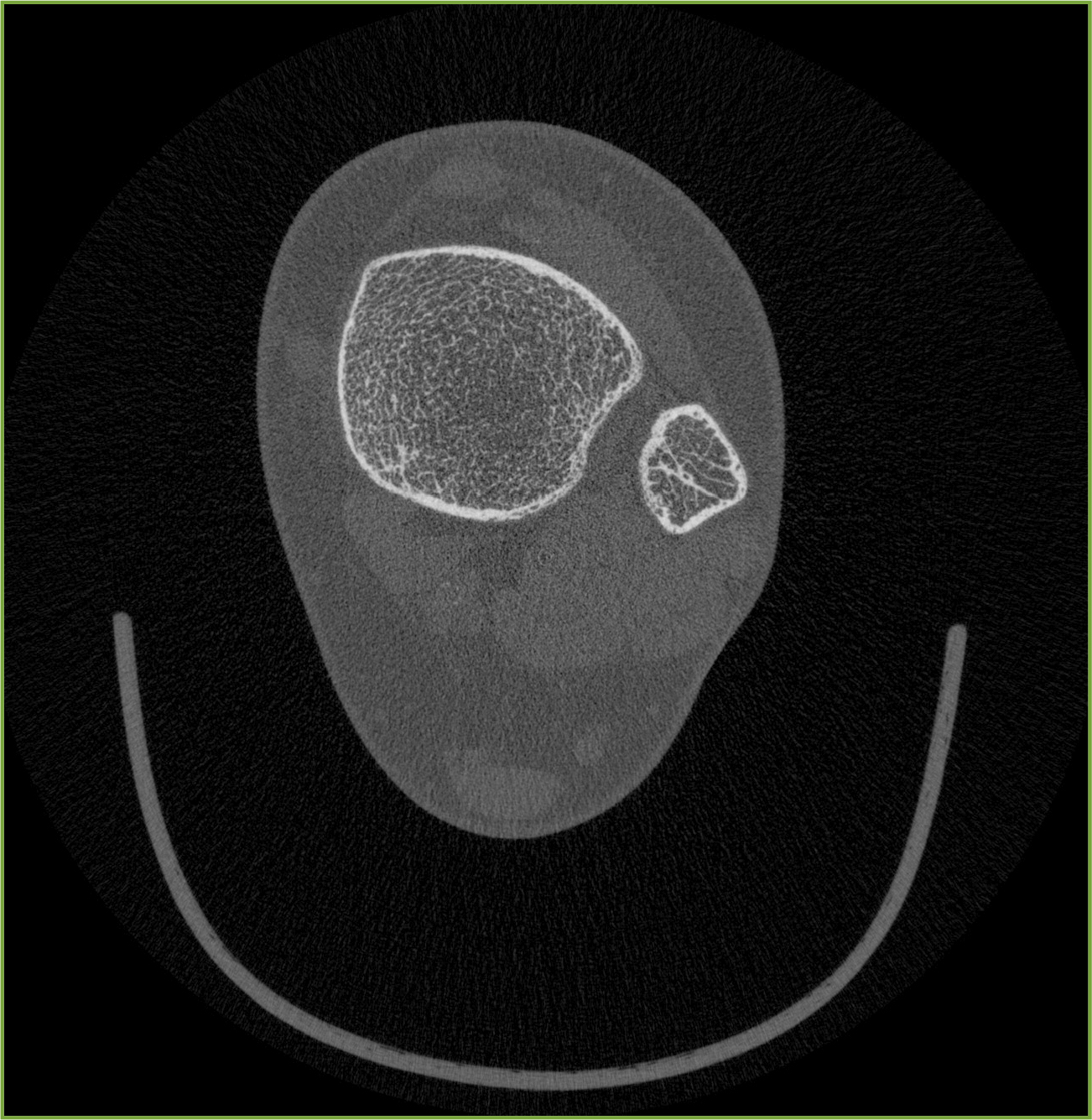
Abb. 2: Micro-Computertomographische Untersuchung der distalen Tibia (Auflösung 82 μm) bei Vorliegen einer MGUS. Deutliche kortikale Porosität bei wenig ver-änderter Spongiosastruktur. Die Evidenz solcher Befunde ist noch zu gering, um diese Veränderung als pathognomonisch für die MGUS einzuordnen. Einzelfallbeschreibung!
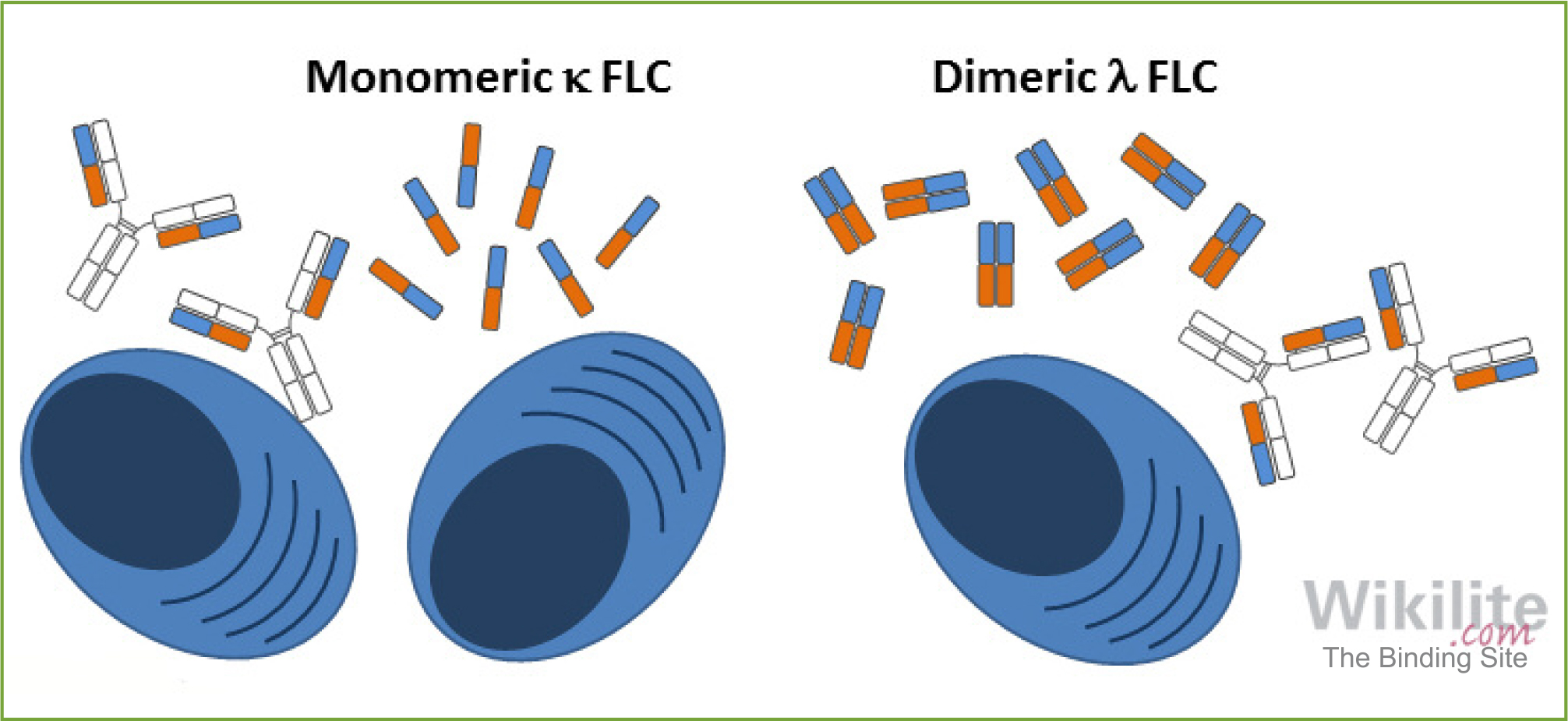
Abb. 3: Gesunde Plasmazellen produzieren und sekretieren intakte Immunglobuline sowie freie monomere Kappa (κ) oder dimere Lambda (λ) Leichtketten-Moleküle im Überschuss. Bei entarteten Plasmazellen kann es zu Veränderungen der Sekretion kommen, die sich im Labor nachweisen lassen können.

Abb. 4: Bestimmung der Freien Leichtketten.
